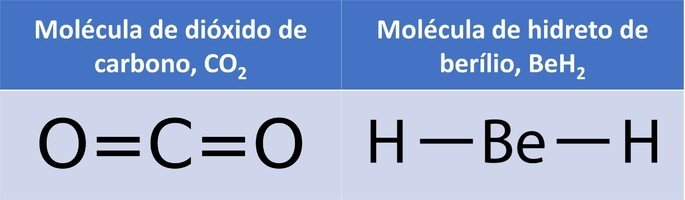
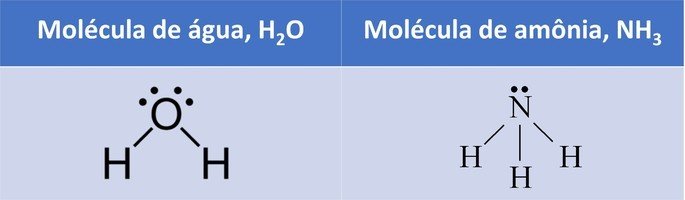
As propriedades periódicas dos elementos químicos são as características que eles possuem.
Note que os elementos químicos da tabela periódica tem um local específico que varia de acordo com as propriedades periódicas que apresentam. Eles estão ordenados por ordem crescente de número atômico.
Segundo a Lei de Moseley:
“Muitas propriedades físicas e químicas dos elementos variam periodicamente na sequência do números atômicos dos elementos.”
Principais Propriedades Periódicas
Raio Atômico
Relacionada com o tamanho dos átomos, essa propriedade é definida pela distância entre os centros dos núcleos de dois átomos do mesmo elemento.
Sendo assim, o raio atômico corresponde à metade da distância entre os núcleos de dois átomos vizinhos, sendo expresso da seguinte maneira:
r = d/2
Onde:
r: raio
d: distância internuclear
d: distância internuclear
Ele é medido em picômetros (pm). Essa medida é um submúltiplo do metro:
1 pm = 10-12 m
Na tabela periódica, o raio atômico aumenta de cima para baixo na posição vertical. Já na horizontal, eles aumentam da direita para esquerda.
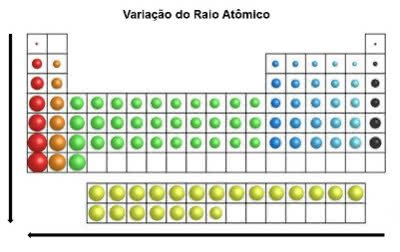
Variação do Raio Atômico
O elemento químico que possui maior raio atômico é o Césio (Cs).
Volume Atômico
Essa propriedade periódica indica o volume ocupado por 1 mol do elemento no estado sólido.
Vale notar que o volume atômico não é o volume de 1 átomo, mas um conjunto de 6,02 . 1023 átomos (valor de 1 mol)
O volume atômico de um átomo é definido não somente pelo volume de cada átomo, mas também o espaçamento que existe entre esses átomos.
Na tabela periódica, os valores do volume atômico aumentam de cima para baixo (vertical) e do centro para as extremidades (horizontal).

Variação do Volume Atômico
Para calcular o volume atômico, utiliza-se a seguinte fórmula:
V = m/d
Onde:
V: volume atômico
m: massa de 6,02 . 1023 átomos do elemento
d: densidade do elemento no estado sólido
m: massa de 6,02 . 1023 átomos do elemento
d: densidade do elemento no estado sólido
Densidade Absoluta
A densidade absoluta, também chamada de “massa específica”, é uma propriedade periódica que determina a relação entre a massa (m) de uma substância e o volume (v) ocupado por essa massa.
Ela é calculada pela seguinte fórmula:
d = m/v
Onde:
d: densidade
m: massa
v: volume
m: massa
v: volume
Na tabela periódica, os valores das densidades aumentam de cima para baixo (vertical) e das extremidades para o centro (horizontal).
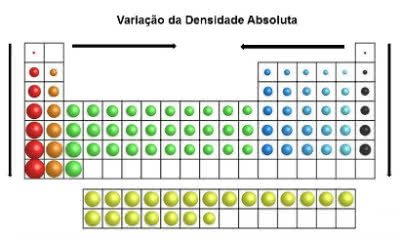
Variação da Densidade Absoluta
Assim, os elementos mais densos estão no centro e na parte inferior da tabela:
Ósmio (Os): d= 22,5 g/cm3
Irídio (Ir): d = 22,4 g/cm3
Irídio (Ir): d = 22,4 g/cm3
Ponto de Fusão e Ponto de Ebulição
Outra importante propriedade periódica está relacionada com as temperaturas nas quais os elementos entram em fusão e ebulição.
O Ponto de Fusão (PF) é a temperatura onde a matéria passa da fase sólida para a fase líquida. Já o Ponto de Ebulição (PE) é a temperatura onde a matéria passa da fase líquida para a gasosa.
Na tabela periódica, os valores de PF e de PE variam segundo os lados que estão posicionados na tabela.
No sentido vertical e no lado esquerdo da tabela, eles aumentam de baixo para cima. Já do lado direito, eles aumentam de cima para baixo. No sentido horizontal, eles aumentam das extremidades para o centro.
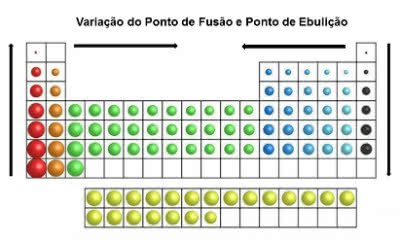
Variação do Ponto de Fusão e Ebulição
Afinidade Eletrônica
Também chamada de “eletroafinidade”, trata-se da energia mínima necessária de um elemento químico com o intuito da retirada de um elétron de um ânion.
Ou seja, a afinidade eletrônica indica a quantidade de energia liberada no momento em que um elétron é recebido por um átomo.
Observe que esse átomo instável se encontra sozinho e no estado gasoso. Com essa propriedade, ele adquire estabilidade quando recebe o elétron.
Em contraposição ao raio atômico, a eletroafinidade dos elementos da tabela periódica cresce da esquerda para a direita, na horizontal. Já no sentido vertical, ele aumenta de baixo para cima.
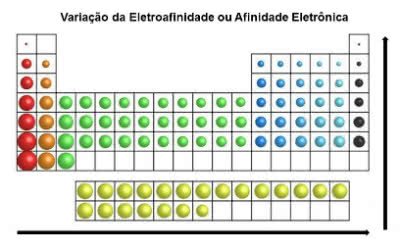
Variação da Afinidade Eletrônica
O elemento químico que possui maior afinidade eletrônica é o Cloro (Cl), com o valor de 349 KJ/mol.
Energia de Ionização
Também chamado de “potencial de ionização”, essa propriedade é contrária à de afinidade eletrônica.
Trata-se da energia mínima necessária de um elemento químico com o intuito de retirar um elétron de um átomo neutro.
Desse modo, essa propriedade periódica indica qual a energia necessária para transferir o elétron de um átomo em estado fundamental.
O chamado “estado fundamental de um átomo” significa que o seu número de prótons é igual ao seu número de elétrons (p+ = e-).
Com isso, após a retirada de um elétron do átomo, ele é ionizado. Ou seja, ele fica com mais prótons do que elétrons, e, portanto, se torna um cátion.
Na tabela periódica, a energia de ionização é contrária à do raio atômico. Assim, ela aumenta da esquerda para a direita e de baixo para cima.
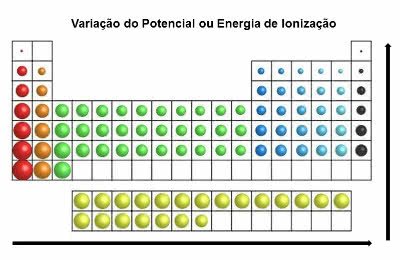
Variação da Energia de Ionização
Os elementos que possuem maior potencial de ionização são o Flúor (F) e o Cloro (Cl).
Eletronegatividade
Propriedade dos átomos dos elementos os quais possuem tendências em receber elétrons numa ligação química.
Ela ocorre nas ligações covalentes no momento do compartilhamento de pares de elétrons. Ao receber elétrons, os átomos ficam com uma carga negativa (ânion).
Lembre-se que esta é considerada a propriedade mais importante da tabela periódica. Isso porque a eletronegatividade induz o comportamento dos átomos, a partir do qual são formadas as moléculas.
Na tabela periódica, a eletronegatividade aumenta da esquerda para a direita (no sentido horizontal) e de baixo para cima (no sentido vertical)
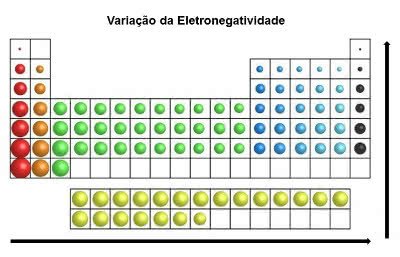
Variação da Eletronegatividade
Sendo assim, o elemento mais eletronegativo da tabela periódica é o Flúor (F). Por outro lado, o Césio (Cs) e Frâncio (Fr) são os elementos menos eletronegativos.
Eletropositividade
Ao contrário da eletronegatividade, essa propriedade dos átomos dos elementos indica as tendências em perder (ou ceder) elétrons numa ligação química.
Ao perder elétrons, os átomos dos elementos ficam com uma carga positiva, formando assim, um cátion.
No mesmo sentido do raio atômico e contrário a eletronegatividade, na tabela periódica a eletropositividade aumenta da direita para a esquerda (horizontal) e de cima para baixo (vertical).
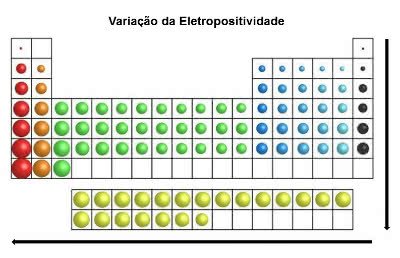
Variação da Eletropositividade
Os elementos químicos de maior eletropositividade são os metais, e por isso, essa propriedade é também denominada de “caráter metálico”. O elemento mais eletropositivo é o Frâncio (Fr) com tendência máxima à oxidação.
Atenção!
Os “gases nobres” são elementos inertes, pois não realizam ligações químicas e dificilmente doam ou recebem elétrons. Além disso, eles possuem dificuldades em reagir com outros elementos.
Sendo assim, a eletronegatividade e eletropositividade desses elementos não são consideradas.
Leia também:
Propriedades Aperiódicas
Além das propriedades periódicas, temos as aperiódicas. Nesse caso, os valores aumentam ou diminuem com o número atômico dos elementos.
Recebem esse nome, pois não obedecem à posição na tabela periódica como as periódicas. Ou seja, elas não se repetem em períodos regulares.
As principais propriedades aperiódicas são:
- Massa Atômica: essa propriedade aumenta conforme o aumento do número atômico.
- Calor Específico: essa propriedade diminui com o aumento do número atômico. Lembre-se que o calor específico é a quantidade de calor necessária para aumentar a temperatura de 1 °C de 1g do elemento.